Le chapitre 42 du livre « Oeil et Maladies Systémiques » (aux éditions LAVOISIERS) du Pr Pascal Sève et du Dr Laurent Kodjekian est consacré à ce sujet.
Extrait avec autorisation de Pascal Sève et de Laurent Kodjikian – Oeil et Maladies systémiques – Paris, Lavoisier Médecine Sciences, 2014, 538 pages.
1 – Généralités
La maladie de Fabry est due à un déficit en α-galactosidase A, une enzyme lysosomale qui dégrade les glycosphingolipides de la membrane plasmique après internalisation par processus endocytaire. Le déficit est responsable du dépôt de glycosphingolipides, en particulier de vacuoles de globotriatosylcéramide (GL-3), dans les lysosomes de très nombreux types cellulaires : (i) cellules endothéliales, péri-endothéliales et musculaires lisses des vaisseaux ; (ii) cellules épithéliales de la cornée ; (iii) cellules nerveuses des ganglions postérieurs de la moelle et du système nerveux autonome ; (iv) les vaisseaux du derme ; (iv) cellules glomérulaires et épithéliales tubulaires du rein ; (v) les cardiomyocytes et les fibrocytes valvulaires ; expliquant les signes de la maladie. Environ 500 mutations du gène codant pour l’α-galactosidase A ont été décrites. La transmission est liée à l’X et la maladie s’exprime surtout chez les hommes hémizygotes ; les femmes hétérozygotes étant cependant souvent symptomatiques mais avec une sévérité plus variable et une apparition plus tardives des symptômes. L’incidence annuelle de la maladie dans la population générale est estimée à 1/117 000 et à 1/40 000 chez les hommes. Les premiers symptômes cliniques apparaissent chez l’enfant, respectivement à 9 ans chez les garçons et 13 ans chez les filles, d’abord sous forme de douleurs des extrémités de type brûlures ou paresthésies, d’une hypohydrose avec intolérance à la chaleur, de troubles digestifs, de lésions cutanées assez typiques de type angiokératomes. Le délai diagnostic est important avec un âge de diagnostic de 23 ans et 32 ans chez les hommes et les femmes.
Le pronostic de la maladie est lié à l’atteinte rénale glomérulaire, qui apparaît en moyenne vers l’âge de 20 ans, longtemps asymptomatique mais qui évolue fréquemment vers l’insuffisance rénale chronique, ainsi qu’aux accidents vasculaires cérébraux et à la cardiomyopathie. Des variants cardiaques ou rénaux de la maladie ont été décrits. L’espérance de vie est réduite de 17 ans chez les hommes et 5 ans, chez les femmes atteints de la maladie, ceci malgré le traitement enzymatique substitutif de la maladie.
Le diagnostic repose sur l’absence d’activité alpha galactosidase (activité <1%), mesurée dans les leucocytes sanguins. Chez la femme hétérozygote, la mesure d’activité peut ne pas être concluante (40%) et l’analyse moléculaire est alors nécessaire. La maladie de Fabry bénéficie d’un traitement enzymatique substitutif injectable par alpha galactosidase alpha (Replagal®, Shire) ou beta (Fabrazyme®, Genzyme) recombinantes humaines depuis 2001 qui a démontré un bénéfice clinique, particulièrement à la phase précoce de la maladie et pour les atteintes cardiaques, rénales, les douleurs et en terme de qualité de vie. Le traitement est institué chez les tous les hommes adultes hémizygotes symptomatiques ou non et chez les femmes hétérozygotes en cas de survenue de symptômes cliniques, en particulier, en présence d’une cardiomyopathie, de maladie rénale débutante évolutive ou avérée (protéinurie>1 g/24 h, lésions vasculaires étendues à la ponction biopsie rénale, insuffisance rénale modérée à sévère), d’accidents vasculaires cérébraux, ou d’atteinte cochléaire sévère. Les enfants sont traités en cas de grandes crises douloureuses à un traitement antalgiques ou, comme chez la femme hémizygote, en cas d’atteinte viscérale. Une surveillance annuelle, rénale, cardiaque (ECG, échographie) et ORL (audiogramme) est proposée.
2 – Manifestations ophtalmologiques
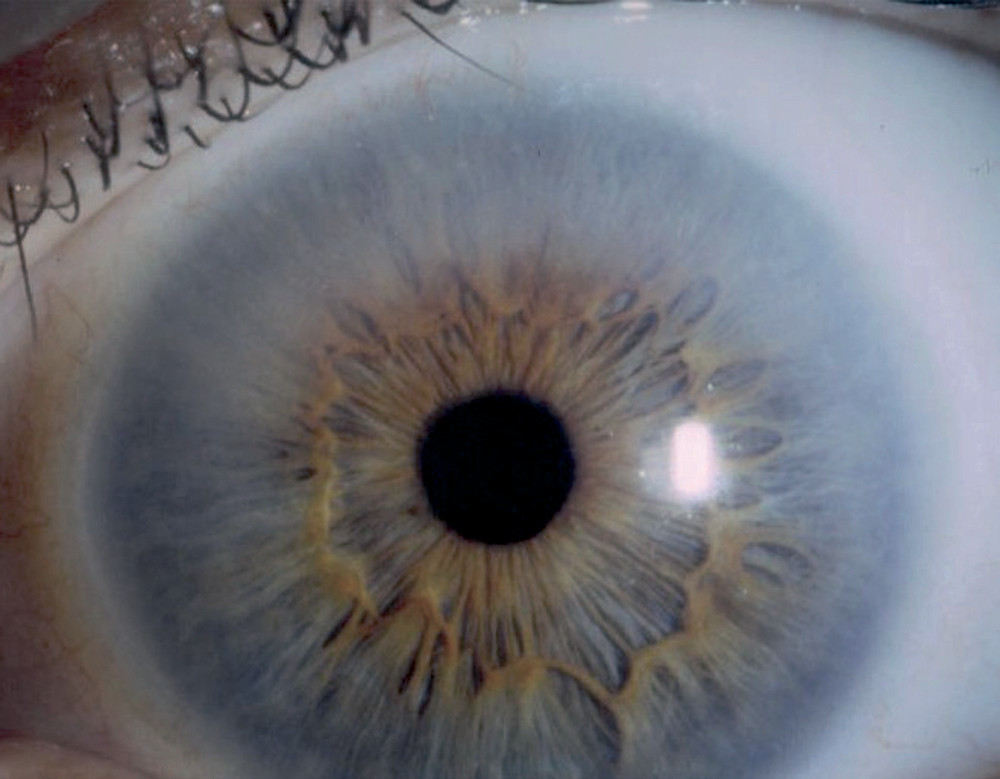
L’atteinte ophtalmologique est présente dans 90 % des cas et est asymptomatique. Les dépôts cornéens constituent un élément diagnostique chez l’homme et un moyen de dépistage simple chez la femme hétérozygote Les dépôts cornéens, au niveau des couches épithéliales ou sous-épithéliales de la cornée ou proche de la membrane de Bowman et observés à la lampe à fente, sont l’anomalie oculaire la plus fréquente touchant la plupart des hommes hémizygotes (76,9%) et des femmes hétérozygotes (73,1%) parmi les 173 patients évalués inclus dans la cohorte internationale; Ils sont présents chez 2/3 des hommes et 77% des femmes avant l’âge de 20 ans. Ils sont bilatéraux et asymétriques et n’altèrent pas la vision. Les opacités sont disposées de façon linéaire, en rayons de roues, de couleur blanche à l’ocre et peuvent être très discrètes. Ces opacités cornéennes ont une disposition dite tourbillonnante, à l’origine du terme botanique de cornée « verticillée ». La cornée verticillée n’est pas spécifique de la maladie de Fabry et peut être observée après exposition prolongée à de nombreux médicaments (amiodarone, antipaludéens de synthèse, ibuprofène, indométacine, phénothiazines, tamoxifène…), à la poussière de silice et au cours du myélome.
Des opacités du cristallin sont rapportées chez 70 % des hommes et environ 35% des femmes ; la cataracte postérieure est la plus fréquente et est considérée comme pathognomonique de la maladie. Il s’agit de lignes blanchâtres presque translucides, le long ou près de la capsule postérieure qui correspondent à des dépots de GL-3. La cataracte antérieure est observée chez 31% des hommes et 5% des femmes ; habituellement bilatérale, elle est visible sous forme de dépôts, granuleux de couleur crème parfois distribuée en hélice.
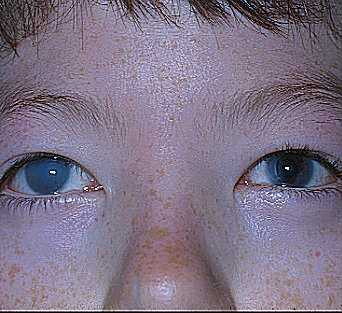
Des télangiectasies conjonctivales ou tortuosités des vaisseaux conjonctivaux sont également fréquents en particulier à la partie inférieure de la conjonctive bulbaire. Elles peuvent être observées dès l’âge de 4 ans chez le garçon et 13 ans chez les filles. Ces anomalies ne sont pas spécifiques et peuvent s’observer au cours du diabète, de la maladie de Rendu-Osler, du syndrome de Sturge-Weber, de fistule carotido-caverneuse, après radiothérapie, au cours du myélome multiple, de la drépanocytose, de la polyglobulie primitive, de la maladie de Louis-Bar et du syndrome de Bloome.
L’atteinte rétinienne est essentiellement vasculaire, plus sévère et plus fréquente chez les hommes hémizygotes (77%) que chez les hétérozygotes (19 %). Elles peuvent être observées dès l’âge de 11 ans chez le garçon et 13 ans chez les filles. Il s’agit de tortuosités et des dilatations segmentaires des artérioles et des veines rétiniennes en forme de tire-bouchon, dues aux dépôts des glycosphingolipides dans les vaisseaux. Ici encore, ces anomalies sont non spécifiques et peuvent se rencontrer au cours de la drépanocytose, des polyglobulies, leucémie, syndrome d’hyperviscosité, de la neurofibromatose de type 1 et de la maladie de Rendu-Osler.
L’impact de l’enzymothérapie substitutive sur l’évolution des atteintes ophtalmologiques n’est pas connu. Une surveillance ophtalmologique est proposée tous les 12 à 24 mois.
Références
- Eng CM, Fletcher J, Wilcox WR, et al. Fabry disease: baseline medical characteristics of a cohort of 1765 males and females in the Fabry registry. J Inherit Metabol Dis, 2007, 30: 184-192.
- Sodi A, Ioannidis A Pitz S. Ophthalmological manifestations of Fabry disease. 2006.
- Sodi A, Ioannidis AS, Mehta A, et al. Ocular manifestations of Fabry’s disease: data from the Fabry Outcome Survey. Br J Ophthalmol, 2007, 91: 210-4.
- Thomas JA, Beck M, Clarke JT Cox GF. Childhood of onset of Scheie syndrome, the attenuated form of mucopolysaccharidosis I. J Inherit Metabl Dis, 2010, 33: 421-427.
MPS-1 : Physiopathologie
MPS-1 : Faire le diagnostic
Mucopolysaccharidose de type I et manifestations
La mucopolysaccharidose de type I (MPS I) appartient au groupe des maladies de surcharge lysosomale comptant une cinquantaine d’affections génétiques1. La MPS I est la plus fréquente des mucopolysaccharidoses. La prévalence à la naissance pour toutes les MPS est d’environ 3/100000 soit environ 24 nouveaux cas de MPS par an en France2.
Dans la MPS I (syndrome de Hurler, de Hurler-Scheie et de Scheie), un déficit enzymatique en α-L-iduronidase entraîne une pathologie invalidante, multisystémique et hétérogène, caractérisée par un large spectre d’atteintes cliniques. Le mode de transmission de la maladie est autosomique récessif (bras court du chromosome 4)3. Le déficit enzymatique entraîne une accumulation dans les cellules saines de 2 glycosaminoglycanes (GAG) : l’héparane sulfate et le dermatane sulfate. Chaque patient est cas unique sur le plan de l’âge d’apparition des troubles, de l’ordre d’apparitions des symptômes cliniques, et de l’évolution de la maladie.
Dans sa forme la plus grave (Hurler), le décès survient avant l’âge de 10 ans. La forme la plus atténuée (Scheie), dévouverte par un ophtalmologiste, est associée à une morbidité importante et à une qualité de vie très altérée. Le pronostic vital de ces patients Scheie est conditionné par l’atteinte cardio-respiratoire.
Manifestations oculaires 4, 5, 6
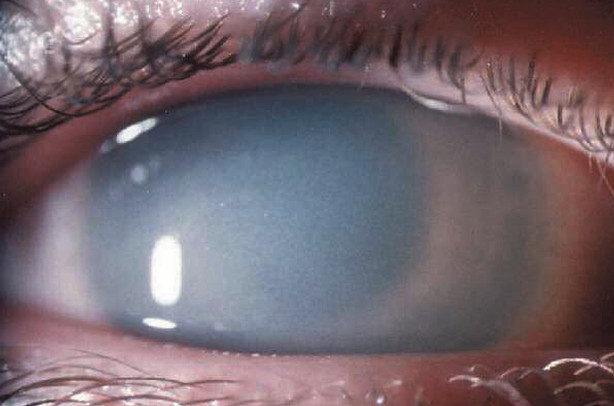
La principale atteinte oculaire est l’opacité cornéenne. Une opacification progressive de la cornée est un signe rencontré chez 86% des patients atteints d’une forme atténuée de MPS I. Elle est accompagnée d’une diminution progressive de l’acuité visuelle pouvant aller jusqu’à la cécité. Les atteintes oculaires entraînent parfois une photophobie.
Critère de suspicion majeure :
- Opacité cornéenne
- Bilatérale et progressive
- Diffuse sur l’ensemble des couches de la cornée
- Diminution de l’acuité visuelle
Critères de suspicions mineurs :
- Les anomalies du point aveugle (tache de Mariotte) sont fréquentes dans la MPS I Hurler/ Hurler-Scheie et rares dans le phénotype Scheie : œdème papillaire, atrophie du nerf optique.
- Une rétinopathie peut aussi être observée chez les patients atteints du syndrome de Scheie.
La mucopolysaccharidose de type I (MPS I) est une maladie multisystémique dont le diagnostic est souvent posé trop tardivement. Les patients atteints de cette maladie évoluent de manière inéluctable vers un handicap sévère.
Le diagnostic de MPS I forme Scheie se fait par le biais de l’association inhabituelle de plusieurs atteintes :
- Opacité cornéenne
- Antécédents de hernies inguinales et ombilicales7
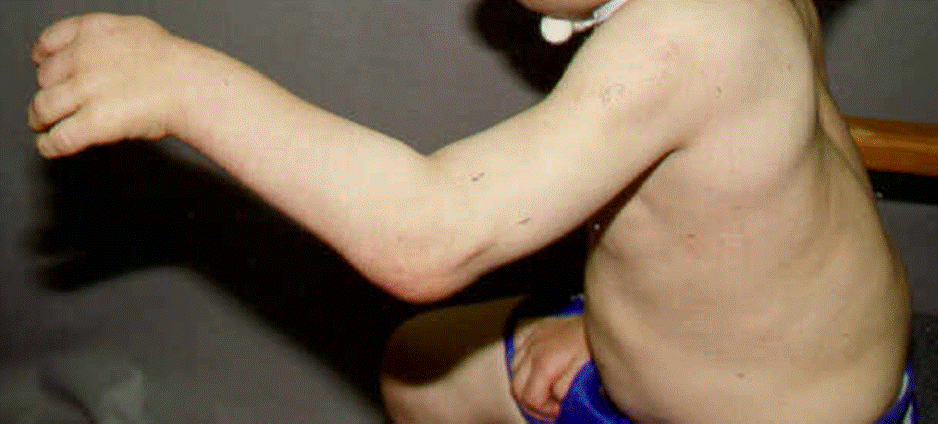
- Raideurs articulaires (progressive et sans signes inflammatoires)8
- Valvulopathies : sujet jeune et atteinte principalement mitrale et aortique (double atteinte chez 60% des patients)9
- Syndrome du canal carpien (atteinte bilatérale chez un sujet jeune) : cause de chirurgie la plus fréquente chez les patients Scheie10, 11, 12.
Ces signes cliniques sont fréquemment observés chez les patients atteints de mucopolysaccharidoses. L’absence d’un ou plusieurs signes n’exclut pas le diagnostic.
Diagnostic et prise en charge3
L’orientation biologique se fait par dosage quantitatif et qualitatif des GAG. La confirmation du diagnostic est réalisée par dosage de l’activité enzymatique leucocytaire spécifique. (Ces analyses doivent être réalisées dans un laboratoire spécialisé : liste sur www.orpha.net). Deux thérapeutiques sont disponibles : la thérapie enzymatique substitutive et la transplantation de cellules souches hématopoïétiques pour les patients atteints d’une forme sévère, âgés de moins de 2 ans et demi.
Bibliographie
(1) – Muenzer et al. Mucopolysaccharidosis I: Management and Treatment Guidelines. Pediatrics 2009;123(1): 19-29
(2) – D’après les cahiers d’Orphanet : Prévalence des maladies rares : Données bibliographiques. Numéro 1 Juillet 2015
(3) – Protocole National de Diagnostic et de Soins MPSI – HAS – Juin 2007
(4) – Summers and Ashworth. Ocular manifestations as key features for diagnosing Mucopolysaccharidoses. Rheumatology. 2011; 50(5):34-40
(5) – Ashworth et al. Mucopolysaccharidoses and the eye. Surv Ophthalmol. 2006;51(1):1-17
(6) – Ashworth et al. The ocular features of the mucopolysaccharidoses. Eye (Lond). 2006 ; 20(5): 553-63
(7) – Guffon et al. La mucopolysaccharidose type 1 (MPS I) : présentation clinique et traitement actuel. Médecine thérapeutique / Pédiatrie. 2003; 6 (2):91-7
(8) – Cimaz et al. Joint contractures in the absence of inflammation may indicate mucopolysaccharidosis. Pediatric Rheumatology. 2009; 23(7):18
(9) – Thomas et al. Childhood of onset of Scheie syndrome, the attenuated form of mucopolysaccharidosis I. J Inherit Metab Dis. 2010;33(4):421-7
(10) – Arn et al. Characterization of Surgical Procedures in Patients with Mucopolysaccharidosis Type I: Findings from the MPS I Registry. J Pediatr. 2009 ; 154(6): 859-64
(11) – Van Meir et De Smet. Carpal tunnel syndrome in children. J Pediatr Orthop B. 2005; 14(1):42-5.
Bahadir et al. Mucopolysaccharidosis Type-IS Presenting With Onset of Carpal Tunnel Syndrome at Adolescence. J Clin Rheumatol. 2009; 15(8):402-4.